正文
化疗属于最经典的肿瘤治疗手段,但众所周知毒副作用非常大。针对于肿瘤表面高表达的抗原,ADC可以把更高效能的毒素带到肿瘤细胞从而有效杀伤肿瘤组织,大大降低对其它正常组织的影响。因此ADC可以逐渐取代化疗达到特异性杀伤肿瘤的疗效。化疗不仅毒副作用大,它还显著抑制人体的系统免疫功能。ADC起到局部杀伤肿瘤, 特别是有些类毒素 (Tubulysin and PBD) 还可以引起 immunogenic cell death,激活dendritic cells 活性,从而提高免疫系统功能。由此可见ADC和免疫 checkpoint inhibitor 合用会产生更好的抗肿瘤治疗效果。现在有不少这样的临床试验正在进行中。
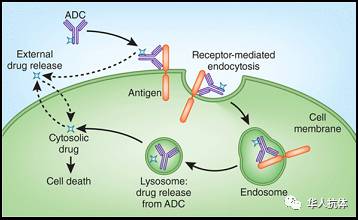
图1: ADC作用机制
ADC 在血液循环里保持稳定,只有通过抗体结合到肿瘤靶点才会释放携带的毒素到肿瘤细胞。 ADC 首先通过特异性抗体结合肿瘤表面抗原,然后整个抗原抗体复合物一起进行endocytosis(细胞内吞作用), 先到 endosome(核内体), 然后到lysosome (溶酶体)。 在溶酶体内毒素被从ADC中释放,最后毒素进入到细胞质,导致细胞死亡。还有一种情况,如果ADC在肿瘤微环境里不太稳定,毒素会在细胞外释放,然后穿过细胞膜进入肿瘤细胞内引起细胞死亡。
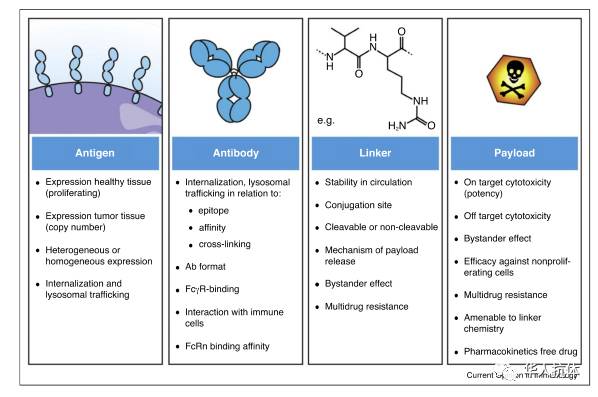
图2: ADC组成成分
ADC 包括三部份: 1)针对肿瘤表面抗原产生的抗体(Tumor Antigen antibody); 2) 杀肿瘤的毒素(Toxin payload);3)连接抗体和毒素的连接区 (Linker)。 下面对每个组成成份进行详细说明。
1)肿瘤表面抗原和特异性抗体的选择 (Tumor Antigen and antibody)
: ADC最理想的肿瘤靶点应该只在肿瘤表达但不在正常细胞组织表达。但是肿瘤细胞是从正常细胞突变过来的, 所以这种理想化的肿瘤靶点是很难找到的。在实际应用中只要选的ADC靶点在肿瘤中的表达远远超过正常组织,这样通过抗体结合肿瘤表面抗原,ADC就会选择性的把毒素带到肿瘤 。对抗体的选择包括抗体要有较高的亲和力(high affinity);有较强的特异性(high specificity);抗体应该用人源化(humanized)或全人 (human) 抗体;ADC中的抗体成份还应该有较强的内吞功能 (internalization)因而有效携带毒素进入肿瘤细胞内部,然后转运到溶酶体(lysosome)从而有效释放毒素杀伤肿瘤细胞。
2)杀肿瘤的毒素(Toxin payload)
:ADC用的毒素主要分两大类,第一类是微管抑制剂(anti-microtubule agents)包括 maytansinoids (DM1) 和 auristatin (MMAE, MMAF)。微管毒素主要抑制快速生长分裂的细胞,所以对肿瘤细胞有一定的特异性。目前通过的ADC药物Trastuzumab Emtansine (T-DM1) 用的是前者;Brentuximab Vedotin 用的是后者。还有在临床试验中的ADC大多使用的是这类毒素。
第二类是DNA抑制剂 (DNA damage agents)包括 烷基化试剂 (Alkylating agents such as Duocarmycin); 抗生素用来产生DNA双螺旋断裂(the enediyne antibiotics including calicheamicin); 结合DNA 小沟的制剂 (pyrolobenodiazepine,(PBD))。DNA毒素效力超级强, (IC50 在 picomole 范围), 主要抑制DNA复制转录修复功能,所以对所有细胞都有杀伤功能。因此当ADC用DNA毒素杀肿瘤,尽管它的功效非常好,它的毒副作用也比较严重。Seattle Genetics 最近宣布 停止Vadastuximab Talirine (SGN-CD33A) 三期 临床试验,由于用药病人出现了较高的死亡率。SGN-CD33A 使用的是PBD毒素,所以DNA抑制剂这类毒素的安全性还有待于更多临床试验的证实。
3)连接抗体和毒素的连接区 (Linker)
:设计连接区的几个要点, 第一 要在血液循环中稳定,确保没有毒素的释放; 第二 当ADC 进入肿瘤细胞,毒素要被有效释放;第三 要尽量设计亲水性的连接区,以避免ADC 聚合物的形成。ADC 聚合物被肝清除的时候不但容易引起肝毒性(hepatotoxicity), 而且还容易引起免疫原性 (immunogenicity)。亲水基团(hydrophilic moiety)包括 sulfonate groups,polyethylene glycol (PEG) group,或者pyrophosphate diester groups 已经用来加在连接区来提高整个ADC 的亲水性。四种连接区设计已经出线在临床试验中,腙(hydrazones)依靠酸性环境释放药物; 二硫化物(disulfides)依靠还原的巯基释放药物;组织蛋白可切的双肽 (cathepsin B cleavable dipeptides)依靠酶切释放药物; 和不可切的(noncleavable)依靠抗体降解释放药物。比如 Brentuximab Vedotin (aCD30-vc-pAB-MMAE)主要是通过溶酶体组织蛋白酶切断 VC 双肽连接区从而释放MMAE。Trastuzumab Emtansine (aHer2-MCC-DM1)是通过ADC在溶酶体降解释放Lysine-MCC-DM1.

















