正如在这项新的研究中所报道的那样,Stephan和他的团队开发出生物可降解的纳米颗粒,可将T细胞转换为CAR-T细胞。CAR-T细胞疗法是一种特定类型的细胞免疫疗法,已在针对白血病的临床试验中获得有前景的结果。
这些研究人员设计出的这些纳米颗粒携带着编码靶向和清除癌症的嵌合抗原受体(chimeric antigen receptor, CAR)的基因。他们也给这些纳米颗粒标记上让它们附着到T细胞上的分子,从而使得T细胞吞噬这些纳米颗粒。这些T 细胞的内部运送系统随后指导这些纳米颗粒进入细胞核,并且在那里,这些纳米颗粒会溶解掉。
这些概念验证研究证实这些纳米颗粒能够让免疫系统靶向癌细胞。Stephan和他的团队设计出这些新的CAR基因,并将它们整合到细胞核内容纳的染色体上,从而使得T细胞开始翻译这些新的CAR基因,仅需一到两天就产生 CAR受体。
在Stephan团队确定他们的携带CAR基因的纳米颗粒让相当数量的T细胞发生基因重编程之后,他们测试了它们的效果。利用一种临床前白血病模式小鼠,Stephan和他的同事们将他们的纳米颗粒编程策略与先化疗再灌注在实验 室中经过编程表达CAR的T细胞(模拟当前的CAR-T细胞疗法)进行比较。与这些灌注的CAR-T细胞相比,这些纳米颗粒编程的CAR-T细胞毫不逊色。利用纳米颗粒或灌注的CAR-T细胞进行治疗可让这些小鼠的存活期从平均两周增加到平均58天。
3.Nature:利用CRISPR/Cas9构建出更加强效的CAR-T细胞
doi:10.1038/nature21405
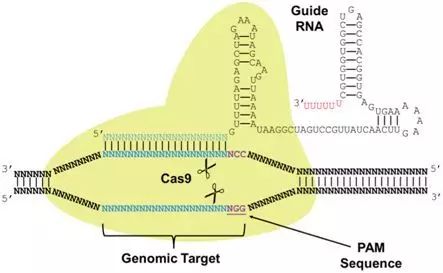
在一项新的研究中,来自美国斯隆凯特林癌症纪念中心(Memorial Sloan Kettering Cancer Center)的研究人员利用CRISPR/Cas9的力量构建出更加强效的嵌合抗原受体(chimeric antigen receptor CAR)T细胞(CAR-T细胞),从而增强小鼠体内的肿瘤免疫排斥。这一出于意料的发现揭示出CAR免疫疗法的一些细节,并且突出展现了利用CRISPR/Cas9基因组编辑技术推动癌症免疫疗法的潜力。
CRISPR/Cas9是一种基因组编辑工具,能够让科学家们精确地切割和操纵细胞中的DNA。在这项新的研究中,这些研究人员证实CRISPR/Cas9技术能够运送CAR基因到T细胞基因组中的特定位点上。这种精准的方法能够更强健地构建出CAR-T细胞---它们能够持续更长的时间地杀死肿瘤细胞,这是因为它们更不容易耗竭。这可能潜在地导致在病人体内更加安全地和更加高效地使用这种强大的免疫疗法。
论文通信作者、斯隆凯特林癌症纪念中心基因转移与基因表达实验室科学家Michel Sadelain博士说,“癌细胞总是无休止地试图躲避治疗,因此我们需要能够制造出与它们相匹配的并且比它们活得更长的CAR-T细胞。这一新的发现证实我们可能能够利用基因组编辑的力量内在地改进这些‘活细胞疗法’。我们迫切地持续探究基因组编辑技术如何可能给我们提供下一代CAR-T细胞疗法。”
4.Mol Ther:以瘤之盾,治瘤之矛:新研究开发出更安全有效的CAR T疗法!
doi:10.1016/j.ymthe.2016.10.016
在像柔道这样的武术中,武士会将对方的力量转回给对方,从而将他们自己的力量增大。而在T细胞与肿瘤细胞的斗争中,T细胞的免疫攻击常常由于肿瘤产生的免疫抑制信号而削弱。这些信号包括抑制性细胞因子白介素-4(IL-4)、白介素-10(IL-10)、肿瘤生长因子Beta(TGF-beta)等,这些因子可由肿瘤微环境中的细胞或基质组分产生。
Mohammed及其同事成功让CAR T细胞避开甚至利用了这些免疫抑制信号。研究人员使用了一种产生IL-4的胰腺癌细胞模型,并用靶向前列腺干细胞抗原(PSCA,一种在前列腺癌细胞中高表达,但是在正常细胞中不表达的蛋白)的CAR T细胞杀伤这些细胞。他们首先确认了暴露在IL-4下的CAR T细胞比暴露在经典刺激因子IL-2下的CAR T细胞的增殖能力更弱。然后他们通过将IL-4受体胞外段与IL-7受体胞内段结合使这些CAR T细胞产生了一种新的反转细胞因子受体(ICR),考虑到这些受体属于常见的gamma链家族,它们可以和普通的gamma链异源二聚化,因此这个新受体在T细胞内可以发挥作用。事实证明这种假设是正确的,这些表达ICR的T细胞在IL-4的刺激下增殖能力反而升高了。此后研究人员让T细胞同时表达抗PSCA的CAR和ICR,结果发现这些T细胞的增殖能力显著提高,其在胰腺癌异位移植模型中杀伤肿瘤细胞的能力也显著增强。













