正文
TEVA布地奈德
仿制研发流程图
由
于普米克令舒的仿制难度较大,目前在美国上市的布地奈德仿制药有4个,其他3个仿制药商分别为WATSON LABS,MYLAN和SANDOZ。凭借质量和价格优势,TEVA公司的布地奈德在2012年全美处方药销售额TOP200排名中达到了第65位,销售额超过了其余三个仿制药商的总和。
因此,虽然数据保护制度延缓了布地奈德仿制上市时间,但TEVA凭借对该高价值仿制药的抢先研发和上市,将因数据保护延迟仿制的损失降到最低。
为抵消创新药市场独占而推迟仿制药上市,对仿制药企业造成的利益损失,仿制药企业可以择优制定首仿药策略,充分规划和调查创新药的市场规模和竞争势态,作出首仿药上市的可行性分析。以美国医药市场为例,一旦首仿药批准上市,仿制药商可以以创新药价格的50%—80%进行销售,并享受180天的市场独占。TEVA公司对于首仿药的丰厚商业利益更是乐此不疲,每年都向FDA提交首仿药的上市申请,见下图。
2009-2013
年
FDA批准
TEVA首仿药上市
数量
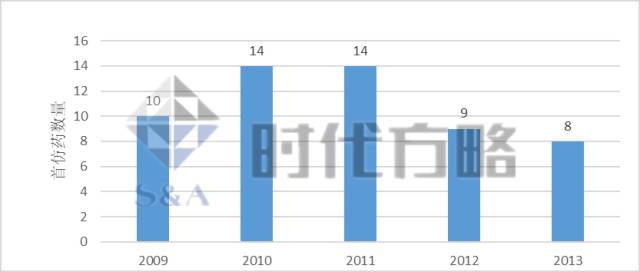
数据来源:TEVA公司2009-2013年报整理
首仿药的技术难度和投资力度都明显强于普通的仿制药的生产,美国为保护首仿药企业的利益,鼓励仿制药的尽快上市,在1984年颁布《药品价格竞争和专利期恢复法案》(Drug Price Competition and Patent Term Restoration Act,也称Hatch-Waxman法案 )的第IV阶段专利申明规定:“专利无效或者批准正在申请的药物不会侵犯专利”的情况下,第一个仿制申请者将拥有180天的市场独占(Market Exclusivity)。这项规定激励了仿制药向创新药发起挑战,从而加速了仿制药的上市。
罗氏公司研制的希罗达(Xeloda),通用名为卡培他滨(Capecitabine),于1998年4月30日通过FDA批准上市,药品专利期于2013年12月14日到期,2012年希罗达为罗氏创造了16亿美元的销售额。TEVA公司作为第一家仿制药申请商,向FDA递交了ANDA和第IV阶段专利申明,申请卡培他滨的仿制药生产许可。2013年9月16日,FDA批准了TEVA公司的首仿药上市申请。
罗氏公司研发的希罗达的核心专利到期时间是2013年12月14日,数据独占到期时间为2016年12月10日。具体专利信息与市场独占信息见下表。
希罗达专利和数据独占情况





