正文
然而,由于细胞数量和实验手段的限制,染色体三维结构在哺乳动物早期胚胎发育过程中的动态变化却鲜为人知。来自清华大学颉伟研究组和中科院刘江研究组通过优化Hi-C技术【10,13】,开发出了一套适用于极少量细胞的Hi-C技术(sisHi-C, small scale in situ Hi-C),并成功将其应用于小鼠早期胚胎发育过程中染色体三维结构的研究中,揭示了哺乳动物受精前后染色体三维结构的亲本特异重编程过程。
在清华大学方面的工作中,研究者发现,
精子保留了经典的染色体高级结构包括拓扑结构域(TADs)和区室结构。相反,卵子(MII oocyte)染色体呈现出一种均一性结构,并且缺乏拓扑结构域(TADs)和区室结构(compartment)。令人惊奇的是,在受精后,染色体的三维结构迅速呈现为一种极其松散的状态
。
研究人员同时发现,不同于普通细胞,在早期胚胎发育过程中染色体三维结构的建立非常缓慢。这一过程表现为整个着床前发育过程拓扑结构域(TADs)的逐渐巩固以及染色体区室(Compartment A/B)的逐渐隔离。此外,研究人员通过分别对来源于父本和母本的两套基因组进行研究发现,
在胚胎发育早期尽管原核已经融合,两套亲本基因组在空间上仍然是保持部分分离状态
。另外,在受精卵中二者的染色体区室结构(Compartment)显著不同。这种亲本基因组在空间上的分离和染色体区室结构(Compartment)的差异直到8细胞阶段仍然存在。最后,研究者发现在抑制合子基因组激活(ZGA,zygotic genome activation)的情况下,染色体三维结构仍然能够部分建立,这表明
这个时期的基因转录对建立三维结构并不是绝对必要的。
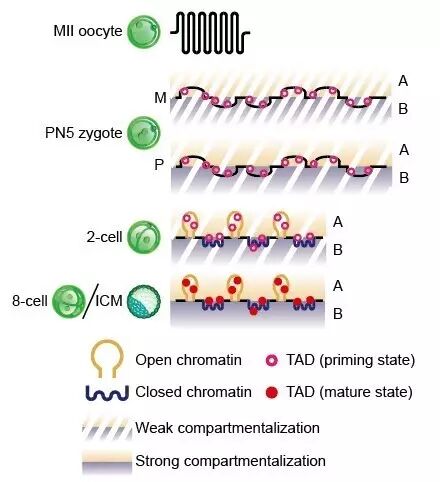
图1. 染色体三维结构在小鼠早期胚胎发育过程中的重编程模型。引自颉伟组
Nature
论文
而来自中科院方面的工作和清华大学方面的工作具有较高的相似性,并且实验结论也高度吻合,这样相互印证的结果更进一步表明了相关的科学性和可重复性。刘江研究组的
实验结果同样表明了成熟卵子(MII oocyte)缺乏拓扑结构域(TADs),而且二细胞器TADs的形成依赖于DNA的复制,但是这个时期合子基因组的激活是非必需的。此外,
研究人员还发现在精子基因组中存在高频的着超远距离(
>4 Mb
)的相互作用。值得注意的是,
该项研究
更详细地描述了精子中的三维基因组结构特点以及三维基因组结构对发育基因表达调控的影响,并发现CpG位点DNA甲基化状态与三维基因组结构建立的相关性。研究表明,
相对于
B
染色体区室结构(
B
compartment
)来讲,
A
染色体区室结构(
A
compartment
)富集有更多未甲基化的
CpGs,这也表明了
A
compartment具有更加松散开放的结构状态。
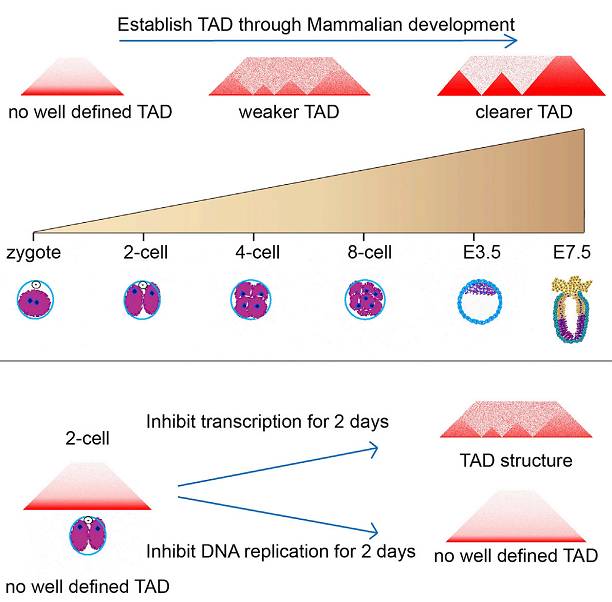
早期胚胎发育过程中TADs建立的动态变化模式图。引自
刘江研究组的
Cell
论文
综上所述,上述工作发现染色体的三维结构在受精后首先呈现出一种极其松散的状态,并在随后的胚胎早期发育过程中逐步地以亲本特异的方式建立和成熟。
两篇文章均很好地描述了配子、合子和早期胚胎细胞的三维基因组结构特点,为研究者认识早期胚胎中真实的立体的基因组结构做了良好的铺垫,也为研究者解释早期胚胎发育中精细调控提供了重要的调控模式。
据悉,清华方面,清华大学生命科学学院
颉伟
研究员为本文通讯作者。清华大学生命学院CLS项目博士生
杜振海
为本文第一作者,清华大学生命学院CLS项目毕业生
郑辉
博士、北京大学前沿交叉学科研究院CLS项目毕业生
黄波
博士和清华大学交叉信息学院硕士生
马瑞
在该工作中做出了重要贡献。清华大学生命学院PTN项目毕业生
吴婧怡
博士和清华大学自动化系博士生
张祥林
也参与了该课题。合作实验室包括清华大学交叉信息学院
曾坚阳
组、清华大学自动化系
汪小我
组、
张奇伟
(Michael Q. Zhang)组、
高军涛
、以及美国索尔克生物研究所(Salk Institute for Biological Studies)
Jesse Dixon
组。课题得到了清华大学实验动物中心和生物医学测试中心基因测序平台的大力协助和支持。该研究获得了国家重点专项研发计划、国家重点基础研究发展计划(973计划)、国家自然科学基金、中组部青年千人计划基金、生命科学联合中心、美国国立卫生研究院、清华大学信息科学与技术国家实验室学科交叉基金、北京市清华大学结构生物学高精尖创新中心的经费支持。
此外,
刘江
研究员和上海科技大学
黄行许
教授为
Cell
论文的共同通讯作者,清华方面的颉伟研究员和博士生杜振海在该文中亦有署名。














