正文
Sunitinib
首先统一进行四个治疗周期(每天一次,
50
毫克,
4
周接受治疗,
2
周停药)。四个周期后的肿瘤负荷(
TB
)减少≥
10
%的患者,符合间歇给药试验标准
(n=20
人
)
,停药,每两个周期再扫描检测
TB
。如果
TB
增加≥
10
%,则重新接受
Sunitinib
治疗,否则一直停药。如此循环。
间歇给药
Sunitinib,
直至持续疾病进展,或发生不可接受的毒性。主要目标是可行性,定义为符合条件的患者接受间歇性治疗的比例。
Lauren C. Harshman
在同期也发表了编委评论,高度赞扬了该临床试验的重要意义。当然,
Harshman
也提出了众多的试验设计改进建议
[2]
。我们这里就多表扬,少批评了。
FDA-approved targeted therapies for advanced renal cell carcinoma

从疗效上看,试验结果太过积极,以至于得想方设法找些试验设计缺陷来掩盖一下,比如样本偏少,患者入组可能有倾向性,Harshman也有类似的观点 [2]。首先我们先看看迄今为止所有FDA批准的作用于晚期肾细胞癌靶向疗法的数据。最好的一线疗法,Sunitinib,Pazopanib,或者BevacizumabVEGF单抗,中位无进展生存期(PFS)大约稳定在10-11个月左右,不同的靶向药物数据都非常接近,后来各种不同的多臂比较试验也是这个数据。而Ornstein等人在完成4个连续给药周期得到的客观反应率(ORR) 为46%,与以前Sunitinib的报道相当 (47%,37%) ,间歇给药得到的中位PFS是22.4个月,整整提高了一倍!如果只计算符合间歇给药入组条件的20名患者,则中位PFS为惊人的37.6个月。还有4名患者治疗还在进行中,意味着最终数据还会提高!
只能感叹一句“前不见古人,后不见来者”,“唯数据之奇高,惶惶然如梦里”。
对了,也被最近的ALK小分子抑制剂罗氏的Alectinib的数据惊到了,PFS比Crizotinib翻番还多!
跟最初预期的结果相符,大部分患者的肿瘤对间歇给药的反应是典型的锯齿状动态浮动变化。同时,试验中没有观察到令人担心的肿瘤报复性反弹现象(tumor flare),(也许是样本少的原因?或者tumor flare发生的概率特别低?特别是在治疗早期。)同时有3名患者肿瘤一直没有进展,也就没有重新给药。显然,这三名患者是临床试验最大的获益者。这也进一步说明了肿瘤的异质性,特别是肾细胞癌,对靶向药物的应答敏感性差异巨大,而VEGFR的靶向药物已经获批十几年了,我们仍旧没有可靠的筛选和预后生物标记物。
Intermittent sunitinib and duration of treatment
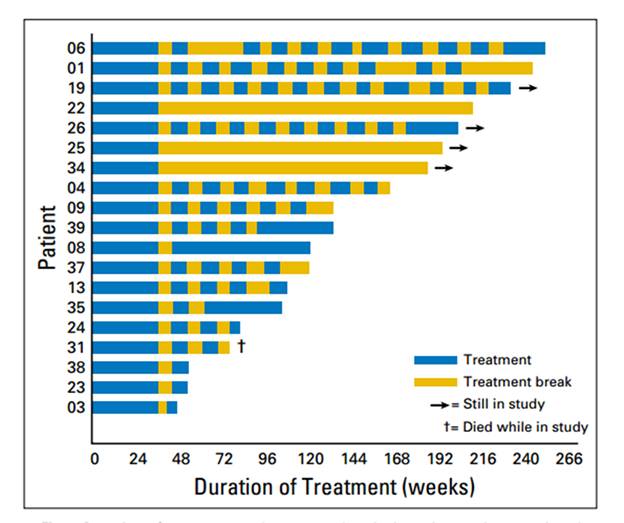
从提高生存质量,降低治疗毒性来讲,间歇给药临床试验显然也取得了巨大的成功。单从最初的四个标准给药周期来看,由于毒性而被迫减量的情况就多达17例患者,占46%。Sunitinib的毒性由此可见一斑。
从经济效益来看,显而易见,间歇给药可以有效的降低经济“毒性”。按照平均市价,Sunitinin 一个28天的给药周期为$17,811.83。平均每个患者节省了9个周期,即$160,302 [1]。(估计,保险公司可能愿意付钱开展这样的临床试验。)
当然,由于总体样本偏少,更多入组患者的三期临床试验也正在欧洲开展[3]。
至于间歇给药的获益及可行性能否在其它的靶点如EGFR敏感突变,抑或ALK,ROS1等融合突变的人群中重复,也只有将来的临床试验数据才能证明。
我们稍微引申一下,看看这个间歇给药的方案是不是可以拯救一下VEGFR的小兄弟:FGFR。虽然结构相近,血管生成的功能也多有重叠,但由于靶向相关的诸多毒性,如组织纤维化,高磷血症等,大大限制了FGFR靶向药物的开发,至今都还没有药物获得FDA批准。今年的ASCO年会上,我们看到多起针对FGFR小分子靶向激酶药物间歇给药的临床入组试验,与连续给药平行开发,比较。试验结果非常值得期待。











