专栏名称: 华人抗体
| 华人抗体协会 (Chinese Antibody Society). 使命和愿景 两个一:第一个“一”是中国抗体药走向世界的桥梁; 第二个“一”是中美乃至全球抗体领域华人交流合作的平台。两个侧重:侧重于治疗性抗体药; 侧重于中国。 |
目录
相关文章推荐

|
营养师顾中一 · 桃子VC少,但这个特点很优秀! · 昨天 |

|
价值线 · 女孩高考完独自挑着行李回家,网友:这样的孩子 ... · 昨天 |

|
格上财富 · 人生建议:砍掉心中的树枝 · 昨天 |

|
创投学社 · 【理财】券商新客理财,年化5%以上!让你的闲 ... · 昨天 |

|
创投学社 · 【理财】券商新客理财,年化5%以上!让你的闲 ... · 昨天 |

|
广东疾控 · 孩子喝碳酸饮料不要紧,不会影响骨骼发育? · 2 天前 |
推荐文章

|
营养师顾中一 · 桃子VC少,但这个特点很优秀! 昨天 |

|
价值线 · 女孩高考完独自挑着行李回家,网友:这样的孩子到哪里都不会差 昨天 |

|
格上财富 · 人生建议:砍掉心中的树枝 昨天 |

|
创投学社 · 【理财】券商新客理财,年化5%以上!让你的闲钱收益最大化! 昨天 |

|
创投学社 · 【理财】券商新客理财,年化5%以上!让你的闲钱收益最大化! 昨天 |

|
广东疾控 · 孩子喝碳酸饮料不要紧,不会影响骨骼发育? 2 天前 |
|
|
爱范儿 · 智能手机音乐当道,你会用一台非智能的触摸屏 Walkman 来听音乐吗? 8 年前 |

|
中国好文章 · 老 毕 携美女又来了! 8 年前 |

|
红秀GRAZIA · 《速激8》花式撞车地图来了!老司机懂的入~ 8 年前 |
|
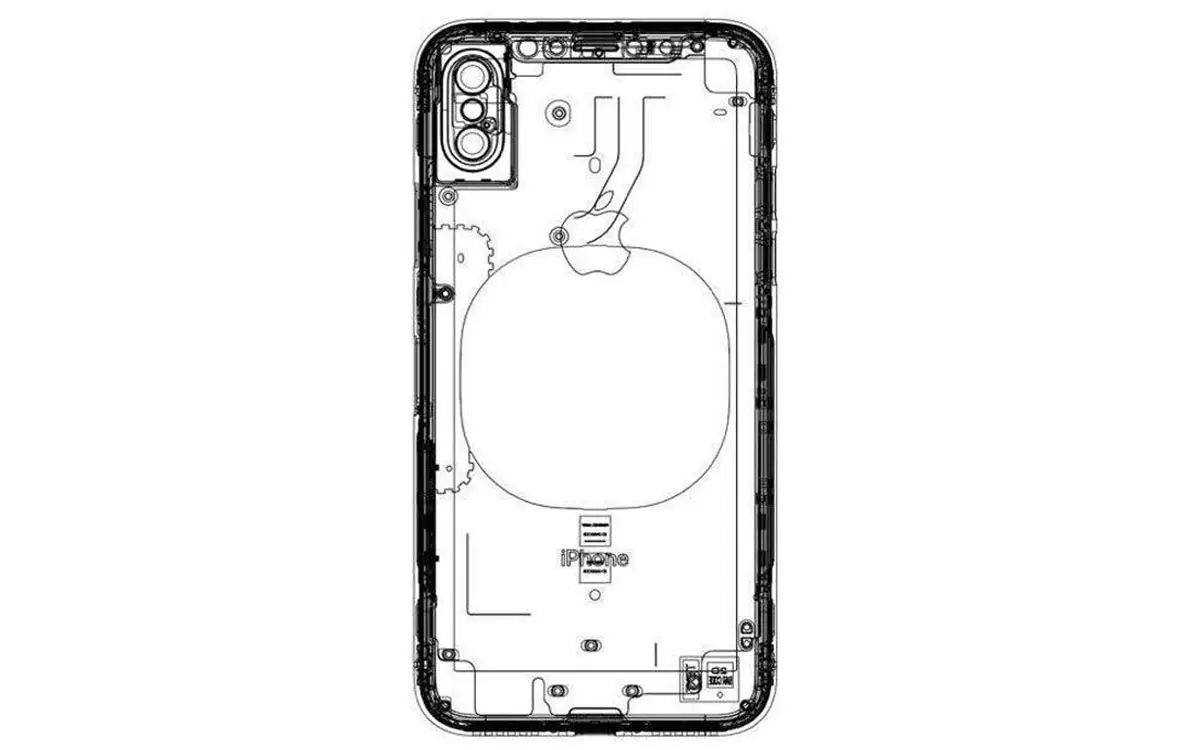
APPSO · iPhone 8 背面长这样,无线充电终于来了? 8 年前 |

|
好玩的数学 · 最近被刷屏的这道小学数学题,你怎么看? 7 年前 |
