正文
A. sinomontanum
Nakai
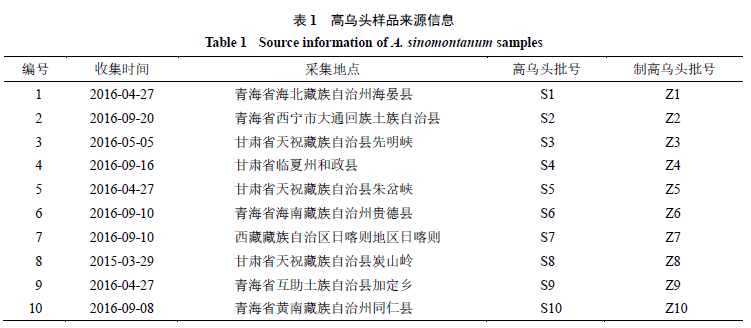
的干燥根,具体编号及来源见表
1
。
LDZX-30FA
立式压力蒸汽灭菌器,上海申安医疗器械厂;
BT125D
型电子天平,赛多利斯科学仪器有限公司;
KQ3200DB
型超声波清洗器,昆山市超声仪器有限公司;
FW-400A
型高建万能粉碎机,北京科伟永兴仪器有限公司;
HHS-11S
型数显恒温水浴锅,上海宜昌仪器纱筛厂;
1100 Series
型高效液相色谱仪,美国
Agilent
科技有限公司,含
DAD
检测器;
SHB-3
型循环水多用真空泵,郑州杜甫仪器厂;
Buchi R-200
旋转蒸发仪,瑞士
Buchi
实验室仪器公司。
高乌甲素对照品,甘肃神龙药业股份有限公司,批号
20001001
,质量分数≥
98%
;冉乌头碱对照品,成都克洛玛生物科技有限公司,批号
150404
,质量分数≥
98%
;乙腈、甲醇、三乙胺、磷酸二氢钠,色谱纯,天津大茂化学试剂厂;石油醚、乙醇,分析纯,天津大茂化学试剂厂;西沙比利胶囊,山东淄博新达制药有限公司,批号
180706
,规格
5 mg
。
昆明种小鼠,
SPF
级,体质量(
20
±
2
)
g
,雌雄各半,由中国农业科学研究院兰州兽医研究所实验动物中心提供,实验动物生产许可证号
SCXK
(甘)
2015-0001
。饲养条件:甘肃中医药大学中药药理实验室,环境温度(
23
±
2
)℃,相对湿度
50%
~
60%
。动物实验经甘肃中医药大学动物实验伦理委员会批准,批准文号
SYXK
(甘)
2015-0002
。
2
方法与结果
2.1
生
、
制高乌头饮片的制备
高乌头药材净制润软后,切制约为
5 mm
的片段,自然干燥,即得高乌头生品饮片。生品饮片用
10%
的甘草汁(
3 mL
含
1 g
甘草)润透后,置立式压力蒸汽灭菌器内,温度
127
℃,压力
0.5 MPa
条件下蒸制
5 h
,取出晾干,即得高乌头炮制品饮片
[10]
。
2.2
生
、
制高乌头石油醚部位的制备
分别取生、制高乌头饮片,加入
10
倍量
95%
乙醇冷浸
24 h
后超声提取,超声(功率
300W
、频率
40 kHz
)
45 min
,冷浸超声提取
2
次,滤过,合并滤液,减压回收乙醇,即得高乌头醇提物。所得稠膏继续加水制成混悬液,用石油醚萃取
4
次,每次
200 mL
,
35
℃以下减压回收石油醚,即得生、制高乌头石油醚部位
[11-12]
。
2.3
溶液的制备
2.3.1
供试品溶液制备
分别取“
2.2
”项生、制高乌头石油醚部位浸膏
0.5 g
,精密称定,加甲醇溶解,定容至
10 mL
,密塞,摇匀,进样前用
0.45 μm
微孔膜滤过,即得。
2.3.2
对照品溶液制备
分别精密称定高乌甲素、冉乌头碱对照品
8.01
、
2.96 mg
,置于
10 mL
量瓶中,加甲醇至刻度线,即得高乌甲素与冉乌头碱混合对照品溶液(含高乌甲素
0.801mg/mL
、冉乌头碱
0.296 mg/mL
)。
2.4
色谱条件
采用
Dikmaspursil C
18
色谱柱(
250 mm
×
4.6 mm
,
5 μm
),流动相为
0.05 mol/L
磷酸二氢钠水溶液
-
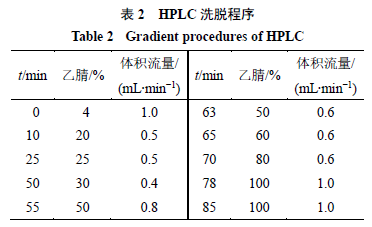
乙腈,梯度洗脱,洗脱条件见表
2
,进样量
10 μL
,柱温
35
℃,检测波长
235
、
254
、
280
、
290
、
308 nm
[13-14]
。
2.5 HPLC-DAD
指纹图谱的建立
2.5.1
精密度试验
取适量高乌头石油醚部位浸膏(
S1
),按“
2.3.1
”项下方法制备供试品溶液,按“
2.4
”项下色谱条件进样分析,连续进样
6
次,将所得色谱图数据导入“中药色谱指纹图谱相似度评价系统(
2012
版)”,得到各图谱的相似度均大于
0.96
,计算
45
个主要共有峰相对保留时间
RSD
<
2%
,峰面积
RSD
<
2%
,表明此方法精密度较好。
2.5.2
稳定性试验
取适量高乌头石油醚部位浸膏(
S1
),按“
2.3.1
”项下方法制备供试品溶液,分别在
0
、
2
、
4
、
8
、
12
、
24 h
,按“
2.4
”项下色谱条件进行测定,将所得色谱图数据导入“中药色谱指纹图谱相似度评价系统(
2012
版)”,得到各图谱的相似度均大于
0.94
,计算
45
个主要共有峰相对保留时间
RSD
<
2%
,峰面积
RSD
<
2%
,表明供试品溶液在
24 h
内稳定。
2.5.3
重复性试验
取适量高乌头石油醚部位浸膏(
S1
),按“
2.3.1
”项下方法平行制得

















