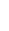正文
2.
2 CARs
技术的治疗优势
使用CARs有一些优于TCR转基因的优势。基于MHC非依赖的抗原识别,CARs能够绕开肿瘤通过下调MHC-I 分子逃避免疫检测的分子机制。从理论上讲,CARs能够检测出几乎所有能被抗体识别的抗原,包括蛋白质抗原、碳水化合物和脂类抗原等,也就是说,CARs更普遍地适用于免疫疗法治疗疾病。此外,CARs细胞内的信号转导结构域具有灵活性,可以设计来补偿肿瘤细胞诱导的共刺激分子表达下调。因此,CAR-T细胞治疗在过继免疫疗法利用最大治疗资源超过TCR-T细胞治疗,后者的主要障碍是效果是HLA/MHC依赖的。
2.3 CAR-T
细胞临床试验
有前途的临床试验给肿瘤患者带来了引人注目的反应,这对激发以CAR-T细胞为基础的过继性细胞免疫治疗在多种肿瘤治疗应用提供了坚实的基础。到目前为止,临床试验利用第二代CD19 CAR-T细胞治疗血液系统恶性肿瘤取得了令人鼓舞的临床反应,CD19-CAR T细胞疗法(CTL019)
已被FDA高度评价并批准作为突破性疗法。目前,靶向CD20的过继性CAR-T细胞对治疗B细胞恶性肿瘤已进入临床试验评价阶段,而其他靶向CD22, CD30和CD33的CAR-T细胞治疗也已经进入体外研究阶段。至今,CAR-T 细胞治疗已经证明成功的作为晚期癌症的一种新的治疗手段,这种手段也成为了全球研究热点。值得提出的是,巨诺(Juno),诺华(Novartis),凯特(Kite)作为全球领先研究CAR-T细胞治疗的大药企归因于它们在CAR-T细胞治疗发展中的开创性贡献。图1显示了在临床治疗用CAR
-T细胞过继免疫治疗的流程图。
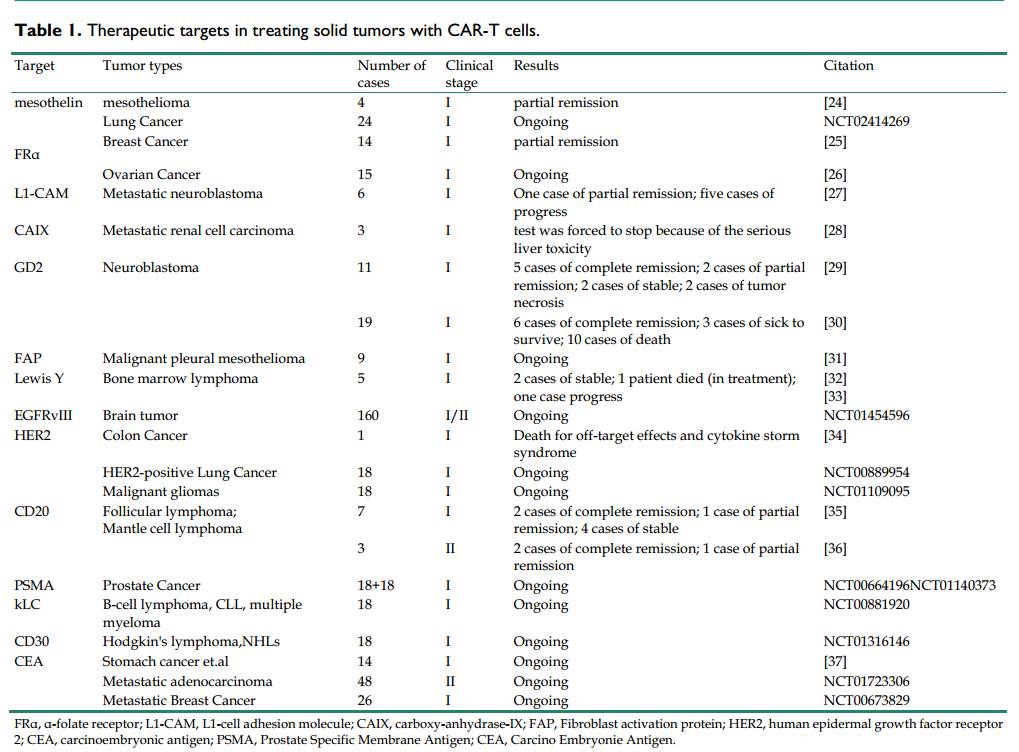
同CAR-T细胞免疫治疗恶性血液病取得显著的临床反应相比,用CAR-T细胞治疗实体肿瘤收到实体肿瘤组织结构,强大的免疫抑制环境所限制,理想靶标的缺失也是治疗实体肿瘤的另一个关键的不足。目前用CAR-T细胞治
疗卵巢癌和成神经细胞瘤的首选靶标分别是FRα和GD2。最新统计与CAR-T细胞免疫治疗实体肿瘤的靶标如表1
所示。
CAR-T细胞通过scFv(通常包含轻、重链可变区)识别细胞表面抗原,以非MHC限制的方式。膜蛋白CD19在几乎所有的B细胞中广泛表达,在B细胞恶性血液病也具有相同的结构特性。所有这些特性导致大多数B细胞恶性肿瘤患者在CD19 CAR-T细胞治疗后表现出令人鼓舞的疗效。但CAR-T细胞治疗在实体肿瘤治疗中的应用严重地受到了异质性特征,肿瘤特异性抗原缺失和免疫抑制微环境的限制。现在我们对CAR-T细胞在实体肿瘤应用中受到的限制因素进行分析以及探讨相关的应对策略。
大多数恶性血液病同造血干细胞再生功能障碍有关,没有形成组织结构。相比之下,实体肿瘤具有特殊的组织病理学特征,比如血管的高浓度,血管壁间隙宽的缺口,大量的血管渗漏,组织结构整体性差等等。这些特征导致实体肿瘤选择性地增强脂质颗粒和大分子物质的渗透性和滞留性。增强的渗透和滞留效应的现象叫做EPR效应。肿瘤浸润淋巴细胞(TIL)大量存在和广泛浸润已经作为多种实体肿瘤病人好的预后和治疗反应良好积极的主要指标,这些实体肿瘤包括结肠癌、肺癌、卵巢癌。实体肿瘤的EPR效应和肿瘤微环境的抑制性在阻碍效应T淋巴细胞浸润到肿瘤组织中发挥着重要的作用。对T淋巴细胞的浸润因素的理解和控制有助于进一步提高靶向肿瘤组织的选择性。
T细胞的转运包括旋转、粘附、外渗和趋化,T细胞向肿瘤微环境的转运是T细胞肿瘤免疫治疗成功的关键。T细胞为基础的免疫治疗对实体肿瘤的临床疗效比晚期黑色素瘤或恶性血液病温和,克服了T细胞迁移的障碍是CAR-T细胞免疫治疗的一个主要挑战,趋化因子受体对失配,粘附分子的下调,和异常的血管也可能导致T细胞的不尽人意的归巢。