正文
跟踪检查不通过的企业有12家,占6.1%,发告诫信的企业有59家,占29.6%。
在检查不通过的12家企业中,2015年度抽验不合格的企业有5家,双随机检查的企业4家,胞磷胆碱钠注射剂生产企业2家,骨肽注射剂生产企业1家。
(一)2015年度质量公告品种抽查情况
共对10家企业进行了跟踪检查,其中5家检查不通过,占50%,另对4家企业发放告诫信。
(二)双随机检查
为落实国务院创新事中、事后监管的要求,按照总局统一部署,药品双随机检查系统于2016年12月首次运行,采取分层双随机的方法对选出的13家企业开展了跟踪检查,包括化学制剂3个、原料药2个、中药8个,分布在9个省。共有4家企业检查不通过,通过率仅69%,另对3家企业发告诫信。
(三)疫苗生产企业
对获得药品GMP证书的38家疫苗生产企业列入2016年跟踪检查计划,除1家因药品生产许可证和药品GMP证书于2014年收回、1家因2015年申请变更生产地址药品GMP证书未拿到没有执行检查外,共对36家疫苗生产企业进行了跟踪检查。检查结果全部通过,共对7家企业发告诫信。其中一家企业因变更分析检测器,检查组现场初步认为属严重缺陷,后期专家研讨认为变更前后的检测器方法原理一致,质量风险较低,要求企业开展进一步的方法学对比验证,降为主要缺陷。总体来说,疫苗生产质量风险可控,生产企业的生产和质量管理较规范。
(四)血液制品生产企业
26家血液制品生产企业列入2016年跟踪检查计划,共对25家血液制品企业开展跟踪检查,另有1家企业因停产整改未进行检查。检查结果全部通过,共对4家企业发告诫信。总体来说,我国血液制品生产质量风险可控,生产企业的生产和质量管理较规范,对个别企业仍需加强监管力度。
(五)2015年发告诫信的企业
共对2015年发告诫信的32家企业进行了跟踪检查,尽管企业基本符合要求,但仍对14家企业再次发告诫信。
(六)认证下放后,对省级认证的无菌药品生产企业抽查情况
共抽查省级认证的无菌药品生产企业21家,全部通过,对其中6家企业发告诫信。通过抽查,省局认证检查的尺度总体把握严格,各地平稳承接了下放的认证检查职能。
(七)高风险品种的专项检查
本年度重点对骨肽、果糖二磷酸钠、胞磷胆碱钠等三个产品的注射剂进行了跟踪检查,
计划进行114家次的高风险品种专项检查,其中有47家因企业未通过药品GMP(2010年修订)认证、品种长期停产、批准文号转移等原因未进行检查,实际检查67家次。1家骨肽注射剂生产企业和2家胞磷胆碱钠注射剂生产企业不通过,对21家企业发告诫信。
二、发现的主要问题
(一)总体情况
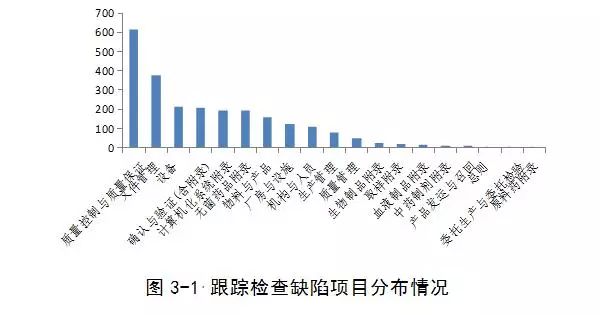
204家次检查共发现2260条缺陷项,其中严重缺陷22项,主要缺陷212项,一般缺陷2026项,与2015年GMP认证、跟踪检查相比严重缺陷数目有所增加。
在高风险品种专项检查的企业中品种长期停产或未通过药品GMP(2010年修订)认证的现象比较突出,检查发现的一些共性问题如下:
1.个别存在生产工艺与注册工艺不一致问题。
2.数据可靠性问题仍然存在,包括伪造生产记录,检验记录中套用图谱、擅自修改数据问题,生产、设备、物料记录中相关内容不符等问题。
3.工艺验证不充分,特别是变更生产批量后未进行工艺验证的问题较多。
4.数据管理的规范性问题突出,主要体现在系统权限设置、审计追踪功能、文件和数据的修改及删除权限等未进行控制,以及对删除数据和选择使用的数据没有合理控制和解释。
5.计算机化系统、确认和验证两个附录的实施情况与法规要求存在一定差距,发现问题较多。
6.对偏差和变更的管理较薄弱,主要体现在对发生的偏差不能有效识别并记录,对变更缺少必要的评估和验证。
(二)2015年度抽验不合格的企业
检查10家企业共发现严重缺陷11项,主要缺陷27项,一般缺陷84项。
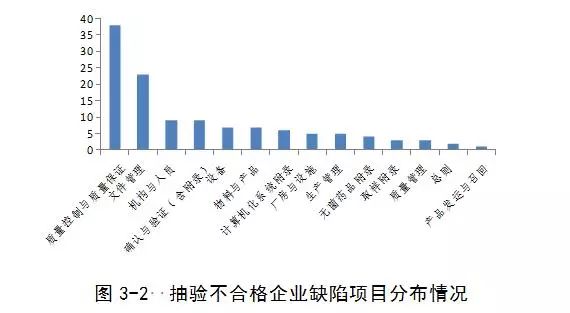
发现的主要问题包括:生产工艺与注册工艺不一致,数据可靠性问题,工艺验证问题。
(三)双随机检查
发现严重缺陷5项,主要缺陷24项,一般缺陷123项。
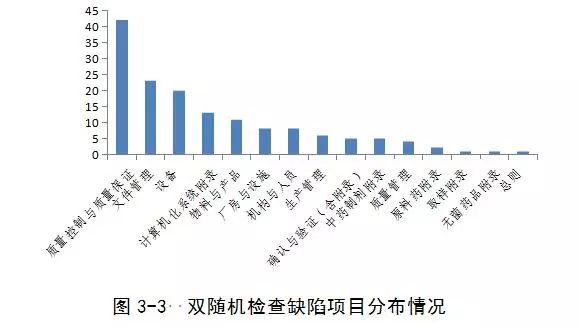
发现的主要问题包括:伪造记录,产品存在质量安全隐患,数据可靠性问题,工艺验证存在问题,物料管理不规范,存在污染、混淆和差错风险,清洁不彻底,不能有效防止污染和交叉污染。
(四)疫苗生产企业
发现主要缺陷38项,一般缺陷383项。
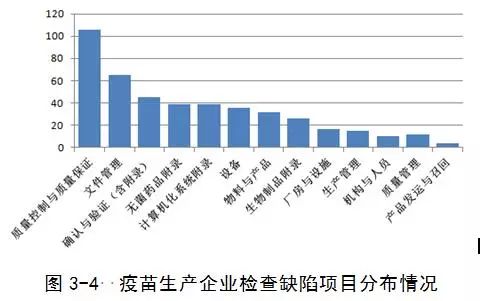
发现的主要问题包括:
1设备方面。注射用水制备系统进入注射水储罐的不锈钢管路阀门到制水机之间过长。
2.物料与产品方面。成品不合格品销毁记录有待细化;个别货位卡缺失;未建立生产用的菌毒种主种子全基因序列的背景资料。
3.文件管理方面。个别文件规定不够具体、操作性不强,文件规定的内容与实际稍有出入;个别记录内容不全面;批生产记录设计内容不合理,实际操作时填写容易造成不及时。
4.质量控制与质量保证方面
(1)质量实验室管理:未向接受委托检验的机构索取必要的检验数据和图谱。
(2)偏差处理:企业偏差处理相关文件的培训、执行不到位;个别偏差未能及时启动调查;少数偏差原因分析和纠正预防措施不到位,对偏差可能引起的对产品质量的潜在影响没有充分评估。
(3)变更控制:变更未按变更流程处理并申报注册补充申请。对某些变更没有进行评估或评估不充分。
(4)供应商管理:对关键物料供应商的审计内容有待细化,供应商审计内容针对性有待提高。
(5)产品质量回顾:应按品种分别进行年度质量回顾,且回顾中对CAPA有效性分析不足;年度产品质量回顾分析报告分析内容可进一步细化。
5.计算机化系统。企业制定了计算机化系统管理的文件制度,但并未完全按照制度分类进行管理,对现有条件不符合文件的情形,未采取有效措施降低风险;质量检验室HPLC检测设备登录界面权限设置要求需细化。





