正文
18-20
日在瑞士巴塞尔举行的
DIA
欧洲年会。在欧盟药监局
(
EMA
)
专场上,听众给
EMA
局长
Emer Cooke
的两个问题尤为瞩目
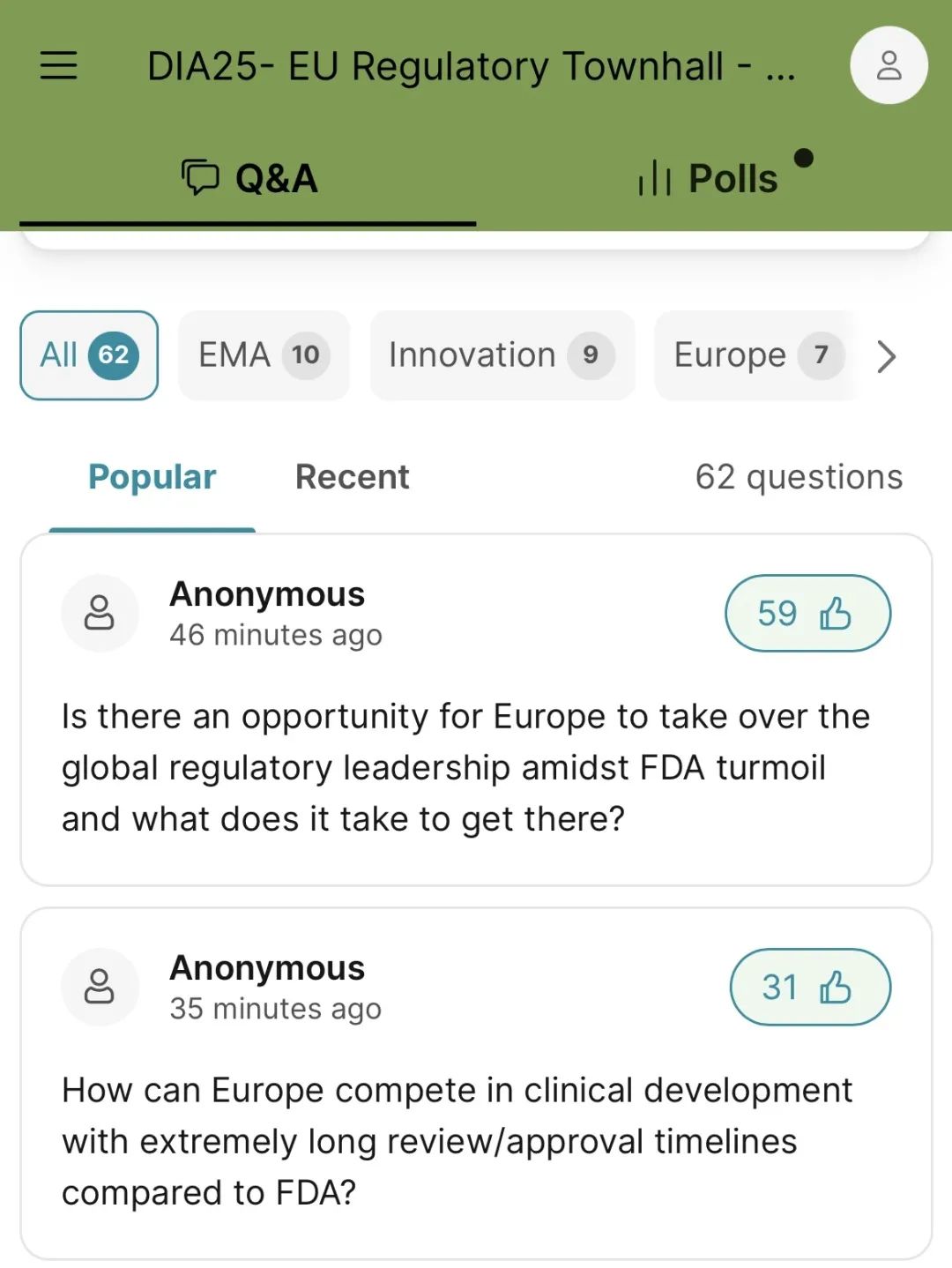
(见图)
:(
1
)在美国
FDA
陷入动荡之际,欧洲是否有机会接过全球监管领导权?实现这一目标需要具备哪些条件?(
2
)在审评
/
批准周期远长于
FDA
的情况下,欧洲如何在临床开发方面保持竞争力?

DIA
一直在积极邀请
Emer Cooke
局长来参加
DIA
中国年会。每次她都是热情洋溢地同意线上演讲,却一直未答应亲自来到中国。上面两个问题,突然让我意识到,我们错了,因为我们只是关心
DIA
会议的需求,没有从深层了解和关注
Emer Cooke
局长和
EMA
的愿景、需求和压力。
从利己到利他的思维模式改变,让我想起了现在如火如荼的生物药
“
出海
”
热潮。同当年大跃进一样,
“
出海
”
变成了一种
“
时髦
”
。没有
“
出海
”
这个话题,会议都会觉得低人一等。其实
“
出海
”
不是问题,问题的本身,还是我们大部分企业还是处在
“
出海
”1.0
模式,或者单纯的贸易思维模式:只关注自己的需求,把产品卖出去或寻找新的融资渠道,而没有进行有效的市场调研,没有很好
地
研究目标市场在哪里,及其政策和临床需求。就像与人交流,只关注自己在说,没有很好的聆听,不做预习和功课。
我曾经陪同中国
15
家企业访问沙特药监局。会上大家问的,都是
“
我能不能不在沙特做临床试验?
”“





