正文
记者在采访中了解到,韩国、澳大利亚、日本等国家曾通过一系列国家层面的政策推动临床研究发展。其中,澳大利亚又以真正意义上的备案制度为特色,大部分肿瘤药只需提交研究者手册、研究方案两项材料,通过伦理委员会的审核即可进入临床试验。
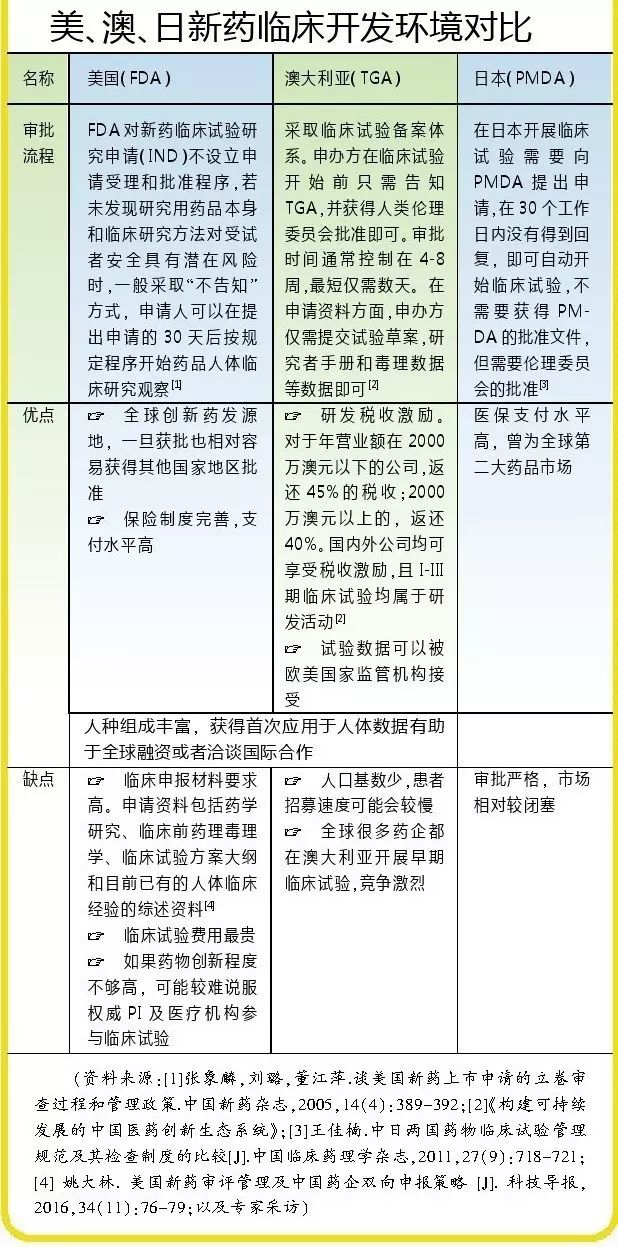
“澳大利亚临床试验的伦理审查由独立的第三方非盈利组织、合同研究组织(CRO)和临床试验现场管理组织(SMO)的独立PI,以及医院中的独立机构把关,相当于一个独立的‘CDE’。”在与该国伦理委员会打交道后,杨大俊深感于其科学性和专业性,审批流程看似简单,但临床风险却能在完善的制度下获得严格把关。
据悉,澳大利亚历时十余年针对新药临床试验建立起一套从申请-审核-批准的完整体系,这套对全球开放的优化体系吸引了各大药企争先恐后到此开展早期临床试验,无论是患者还是PI都得以最快最早接触到全球创新药。
上述报告指出,临床研究是我国现阶段创新药研发的主要瓶颈,挑战集中表现在临床试验质量参差、数量偏低(主要是早期临床数量)以及高水平临床试验机构资源紧张。我国有着全球最庞大的患者基数,但怎样把这些丰富的临床资源转化为对加速新药开发有价值的资源,还有很长的实践之路。
过去,国内企业以仿制药开发为主,跨国企业新药临床试验进入中国往往也是Ⅱ、Ⅲ期阶段,早期临床试验经验十分缺乏。“新药首次人体试验(First-in-human)是摸着石头过河,如何设计临床方案控制风险,如何筛选联合治疗的适应症,都是首席医学官(CMO)的职责范围。在美国,新药临床开发由CMO主导负责,而目前中国做创新药最缺乏的人才就是CMO。”杨大俊表示,临床能力建设是中国未来新药临床开发的另一大瓶颈,这也是研发企业以及中小型企业的短板所在。
谈及加强临床试验能力的建设,北京大学第一医院临床试验中心主任崔一民建议,企业一方面要培养筛选site能力,在选择临床试验中心前,企业或者其委托第三方应对主要研究者、专业科室、以及其机构管理部门进行评估,为保证临床试验质量奠定基础;另一方面要提高方案设计或者方案评估的能力,要掌握药物研发整体思路,设立医学部门,可通过培训培养方案实验设计或评估实验方案的能力。





