正文
2.2 全球化生物制药
随着生物类似药的兴起,人们对全球化生物制药的兴趣也越发浓厚。这也与几个市场对在生物制药本土企业给予优惠待遇有关。中国的情况尤为明显,辉瑞和通用电气联合推出了一种生物类似药生产工厂,名为KU Bio。其他生物制药企业也进入了包括无锡在内的中国市场。2015年12月,中国食品药品监督管理总局(cFDA)宣布,中国将加快药品上市申请的审批程序。在拉丁美洲和南非,生物类似药的本土化生产趋势也开始高涨起来。一系列从事生物药生产的印度公司数量也有明显增长。
2.3. 一次性生产技术
一次性生产技术的增长推动了全球化的生产,这种技术显著降低了基础建设投资。一次性生产技术使全程采用用后即弃的方式迅速用于生产临床样品成为可能。生物制药的一次性生产是一种趋势,现已发展到商业制造领域,已有几家生产厂家先后使用了多个2000L一次性生物反应器来生产生物制药。如安进公司在新加坡的制造工厂利用6×2000L的一次性生物反应器来进行细胞培养。与目前仍处于主导地位的大型不锈钢设备相比,这些技术使生物制药的cGMP生产更容易实现。结合可快速组装的模块化结构,一次性生产成为一种可以在全世界范围内扩展生物制药的技术。
2.4 表达量的提高
最近几十年来,细胞培养的表达量也有显著提高。如今,经14天的批培养后,单抗通常可以达到5 g/L的表达水平。而通过流加生物反应器的持续补料还可以获得更高的表达量。这些进步是由细胞系表达载体的开发、克隆筛选以及细胞培养基的变化所获得的。这种产品表达的增加反过来也促使小型生物反应器(例如2000L一次性生物反应器)能够用于商业生产。
2.5 下游工艺新技术
上游工艺生产率的提高导致下游工序成为生产瓶颈。尽管有人认为目前使用的固定层析工艺能够满足数吨单抗的生产要求,但人们对纯化技术的兴趣仍在增加,以期望其显著提高生产率。近期热点包括对连续生物处理(通常用于连续流加培养和下游操作),以及可以大规模使用的非层析技术。
另一个重新引起关注的领域是非层析分离方式,在这种分离方式可以完全摆脱对层析柱的依赖。
2.6 新一代抗体结构
导致平台方法进化的另一个主要因素是特定的单抗类似构造正被开发为潜在的治疗手段。生物技术产业正迅速超越传统的单抗,涉足包括Fc融合蛋白、双特异性抗体(bsAbs)和融合蛋白在内的各种结构。这些新构造都需要调整原有的单抗平台工艺来支持它们的生产。
Fc融合蛋白是通过将单抗的Fc区域的编码序列与另一种蛋白质的编码序列连接后表达的。Fc区域作为融合部位具有几个优势。许多生物活性肽和蛋白质表现出在肾脏的快速清除,血浆半衰期较短。Fc区域可以与新生的Fc受体结合,延长抗体的半衰期,同时对融合部分也有同样作用。已经批准上市7个Fc的融合蛋白,其中至少有两种(Enbrel和Orencia)每年销售额超过10亿美元,达到重磅炸弹级别。安进公司的单抗原始平台包括了Fc融合蛋白的纯化。然而,对于Fc融合蛋白来说,存在几个关键的下游差异,包括对蛋白裂解的敏感性和比常规的单抗更高的高分子量聚集(HMW)水平的可能性。典型的单抗下游平台方法经过适当调整洗脱条件后通常是可行的,以保证分子的稳定性和多聚体的有效清除。
双特异性抗体(bsAbs)设计为能够同时结合和中和两种不同抗原(配体、细胞受体或细胞因子)或两种不同靶点的蛋白质。由于这一特性,双特异性抗体可以作为调节剂,将免疫效应器和细胞毒性因子,如T细胞,转移到肿瘤或感染细菌内部。抗体的两个手臂不同,这就导致了双特异性抗体的生产工艺的几个挑战。例如,如果抗体的两个单元分别表达,下游工艺需要拆分为两个半部分,然后重新组装以形成一个异质二聚物。除非采用重组工艺,即使采取抑制同二聚物的形成(通过使用一种孔-穴方法或类似的技术以促进异质二聚物的形成),仍会形成少量的同源二聚物,需要在下游处理工艺中移除。因此,这种双特异性抗体的构造需要一个更复杂的下游工艺。
然而,使用一个普通的轻链和孔眼技术(KiH)可以使在细胞培养表达双特异性抗体。由于KiH的构造,使均质聚物的形成受到抑制。如果所选的序列具有生物化学的差异,那么形成的少量的同源二聚物就可以被移除。即使在没有共同的轻链的情况下,也可以做到这一点。例如,来源于Xencor的X单抗技术中,同质二聚物和异质二聚物在其设计的Fc区域中有微小的差异,使它们能够在CEX中分离。该工程改造的另一个目的是提高双特异性抗体的功能效应。
抗体偶联药物(ADC)是一种抗体与细胞毒性剂偶联的一种药物,其主要用于癌症治疗。ADCs下游工序的末端,化学接合步骤除外,其余下游工艺与传统的单抗相同。而这通常需采用超滤/过滤工艺移除未偶联的小分子。与单抗的主要区别在于,由于连接分子的毒性,需要更严格的控制和人员保护。
其他的下一代单抗结构包括在C或N端上对抗体进行融合,以进一步增强同时结合多个靶点的能力。如与抗体结构融合的抗溶蛋白。如图1所示,包括工程scFvs、双抗和三抗,以及以二聚物或三聚物的形式组成的Fab偶合体。如果这些治疗模式成为一种治疗模式,将会导致平台工艺方法的发展。
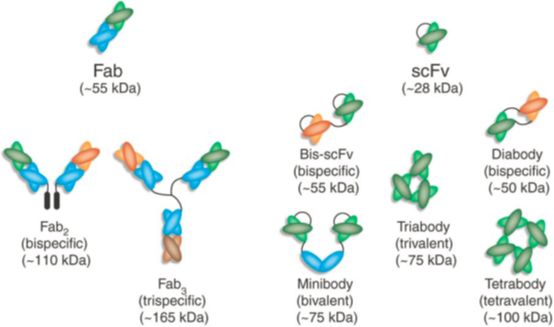
图1
下一代抗体的可能结构
3.1 单抗平台发展驱动
本节概述了几家大型生物制药公司开发并成功地用于大规模生产单抗生产的下游工序。在这些工艺流程中几个方面是通用的。在哺乳动物细胞培养过程中,单抗被分泌到细胞外的培养基中。收获和复苏规程通常采用离心法,然后是深层过滤和一系列的膜过滤器。如果规模较小,可以使用离心分离法,使用一系列的深层过滤器,这些过滤器通常可以重复使用。平台工艺几乎都是蛋白质A的亲和层析。在某些情况下,可以在蛋白质A层析中增加选择性洗脱方式,从而进一步增强宿主细胞蛋白(HCP)的清除能力。非蛋白A的方案已经被开发出来并用于某些治疗蛋白质商业生产,但由于缺乏通用的方法和处理过程的稳健性,所以尚未普遍应用。按照WHO指导原则,工艺应包含两个不同原理的病毒清除工序。低pH病毒活性和纳滤广泛应用于单抗生产。低pH经典方法是蛋白从蛋白质A层析洗脱后,立即置换低pH值的缓冲液中。蛋白A亲和层析和病毒灭活后,采用一种或两种精制层析法来清除高分子量聚合体、宿主细胞蛋白、DNA,并清除潜在的病毒。各平台方法的主要区别在于不同原理精制层析步骤的顺序。鉴于目前在工业中日益普遍的高表达细胞培养过程(5-10g/L),要求精制层析工艺上有很高的柱载量。





