正文

论文解读
:
随着我国居民生活水平的不断提高以及人口老龄化程度的不断加深,目前我国11.6%的成年人为糖尿病患者,占全球总糖尿病人数的1/4左右。有50%以上的糖尿病患者死于心脑血管并发症。血小板异常激活作为中风、冠心病等动脉血栓性疾病的重要病理基础,也是糖尿病人常规服用抗血小板药物预防心脑血管并发症的重要原因。
目前临床常用的阿司匹林、氯吡格雷等抗血小板药物对于部分糖尿病患者心脑血管并发症的治疗效果并不理想,存在阿司匹林抵抗、氯吡格雷抵抗现象,无法有效的减少心脑血管并发症的发生率。因此,明确糖尿病患者血小板异常激活和抗血小板药物抵抗背后的分子机制将有助于推动新型抗血小板药物的研发,为氯吡格雷抵抗的患者的个体化药物治疗提供重要的科学依据。
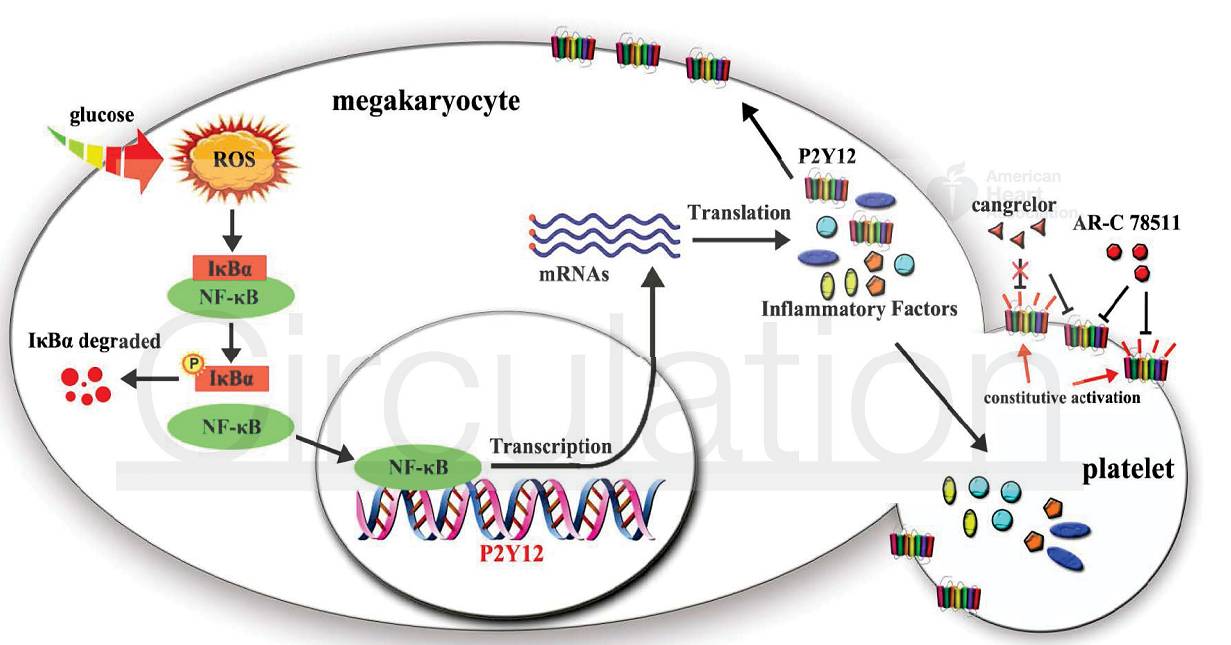
复旦大学基础医学院丁忠仁课题组与华山医院内分泌科叶红英课题组合作研究发现,糖尿病患者和糖尿病大鼠血小板上P2Y12受体表达显著增加、发生受体自发激活,在无激动剂结合的情况下向胞内传递受体激活信号,导致血小板异常激活、体内血栓形成增加。同时本研究发现,与2015年FDA新近审批上市的抗血小板新药cangrelor(坎格雷洛)相比,反向激动剂ARC-78511对于P2Y12受体高表达且自发激活的糖尿病人血小板有更好的抗血小板作用,对糖尿病大鼠具有更显著的抗血小板、抗血栓作用。利用糖尿病大鼠的巨核细胞(血小板前体)和体外高糖环境下培养的巨核细胞,本研究进一步发现ROS - NFκB信号通路激活是血小板P2Y12受体和多种炎症因子表达异常增加的幕后分子机制(
下图
)。