正文
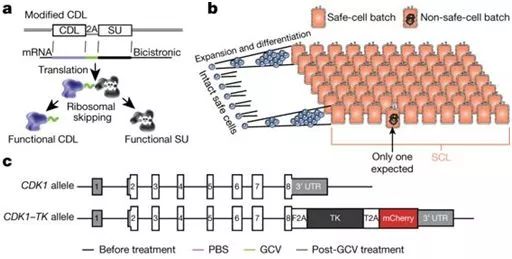
图4. 图片来自Nature, doi:10.1038/s41586-018-0733-7。
2018年10月,鉴于利用造血干细胞治疗白血病或骨髓癌症时会出现移植物抗宿主反应的副作用,Sonia Tugues等人利用小鼠模型发现,在移植物抗宿主反应期间这些移植的细胞会产生大量的GM-CSF因子,如果给与小鼠机体注射了无法产生GM-CSF的供者细胞,那么小鼠就会免受这种致死性反应,因此靶向作用于GM-CSF就能产生一种精准化、特异性的免疫抑制效应,这或许就有望阻断移植物抗宿主反应所造成的组织损伤[7]。
2018年10月,鉴于进行性多灶性白质脑病(PML)是在免疫损伤的情况下,由JC多瘤病毒(JCV)的重新激活而引起的一种通常是致命性的疾病,以及BK病毒(BKV)与JCV同属多瘤病毒科,且基因相似度很高,有大量的免疫原性蛋白序列同源,Muharrem Muftuoglu等人在一项临床试验中让3名PML患者接受来自健康供者的BKV特异性T细胞治疗,表现出了显著的有效性结果[8]。
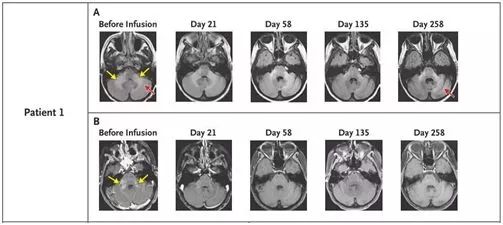
图5. 在接受治疗后,第一名患者脑脊液中JCV完全清除,临床和影像学表现恢复正常,图片来自NEJM, doi:10.1056/NEJMoa1801540。
2018年10月,Marco Ruella等人报道了一名B细胞急性淋巴性白血病患者接受了一款成熟的CAR-T疗法,他的病情快速地得到控制。后续的研究也表明,他体内的CAR特异性序列有保持在较高的水平,然而奇怪的是,细胞计数结果表明这些CAR特异性序列的增加似乎与CAR-T细胞的数量无关。进一步的分析结果表明这些CAR特异性序列竟来自癌细胞[9]。在治疗短短9个月后,这名患者的白血病突然复发,而且由于病情过量,他最终去世了。这些猜测很可能是这些CAR特异性序列在CAR-T疗法制备期间进入到癌细胞中。
2018年10月,Zhen Gu团队首创了一种被命名为“细胞联合药物递送”(cell combination drug delivery,CCDD)的新技术[10]。CCDD是首个将两种不同细胞连接在一起的治疗方法。其中,一种细胞是血小板,被用于运送免疫疗法药物PD-1抗体。这类药物能够让免疫系统能够发现并摧毁癌细胞。另一种细胞是造血干细胞,它能够将血小板带到骨髓处。他们发现在接受CCDD治疗的急性髓细胞白血病小鼠中,80天后,87.5%的小鼠被治愈了。此外,2个月后,当再次给被治愈的小鼠注射白血病细胞,它们都对这些癌细胞有抵抗能力。

图6. 图片来自Nature Biomedical Engineering, doi:10.1038/s41551-018-0310-2。
2018年10月,日本京都大学医院神经外科医生Takayuki Kikuchi及其团队将240万个多巴胺前体细胞植入到一名50多岁的患者的大脑中。在3小时的治疗过程中,Kikuchi及其团队让这些多巴胺前体细胞聚集到12个称为多巴胺活性中心(dopamine activity centre)的位点中。这名患者表现良好,到目前为止没有出现重大不良反应[11]。该团队将观察他六个月,如果没有出现并发症,将在他的大脑中植入另外240万个多巴胺前体细胞。该团队计划在2020年底之前再治疗6名帕金森病患者,以便测试这种技术的安全性和有效性。
2018年9月,Kun Xuan等人在中国开展的I期临床试验中招募了40名儿童患者,其中每个儿童都有一颗恒切牙受损而且仍然有乳牙。30名儿童患者接受人乳牙牙髓干细胞(hDPSC)治疗,剩下的10名儿童患者接受对照治疗,即根尖诱导形成术。他们发现相比于对照组儿童患者,接受hDPSC治疗的儿童患者具有更多的体征表明他们具有健康的牙根发育和更厚的牙本质,而且他们的血流量也增加了[12]。他们还发现这些植入的干细胞能够再生牙髓的不同组分,包括产生牙本质、结缔组织和血管的细胞。

图7. 图片来自University of Pennsylvania。














