正文
靶向巨噬细胞的潜在靶点较多,临床上进展较快的主要靶点有:
CSF-1R
、
CD47
、
CD40、
巨噬细胞微环境趋化因子等。
Macrophage-targeting antitumour treatment approaches
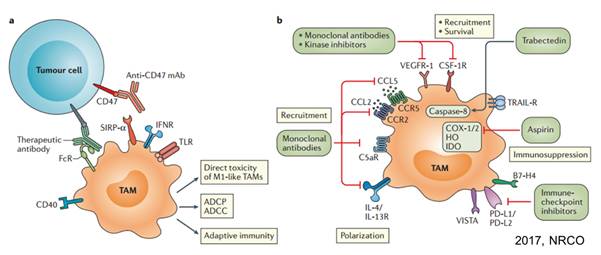
迄今为止,还没有直接靶向巨噬细胞的药物获得
FDA
批准。
CSF-1R
靶向药物
CSF-1R
是迄今靶向巨噬细胞研究最成熟的靶点之一。
CSF-1R
属于络氨酸受体激酶,仅在单核细胞系,如巨噬细胞表面表达,其主要配体之一
CSF-1
与之结合后可以促进巨噬细胞的生长、分化。在多种肿瘤,如乳腺癌、肝细胞癌等中发现,高
CSF-1
或
CSF-1R
表达水平与不良生存预后呈正相关。
靶向
CSF-1R
的策略既可以用大分子抗体靶向其
CSF-1
配体,或
CSF-1R
受体,也可以设计小分子靶向激酶活性区域。
目前临床上活跃的药物包括
5
个抗体、
4
个小分子。较为领先的抗体是
Roche
的
Emactuzumab
(
RG7155
),小分子是
Plexxikon
的
PLX-3397 [7]
。
CSF-1R Targeted agents in clinical trials
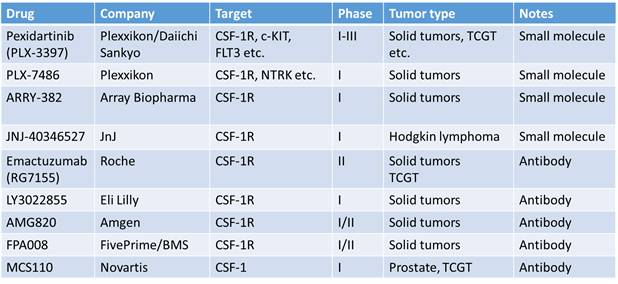
CSF-1/CSF-1R
信号通路大部分情况下不是致癌驱动因素。但在一类罕见的腱鞘巨细胞瘤(
TCGT
,
tenosynovial giant-cell tumor)
,
CSF-1
却是元凶。这类细胞瘤主要发生在关节部位,特别是膝关节。发病人群较为年轻,平均年龄为
35
岁左右。目前主要治疗手段是手术,但复发率比较高,患者急需新的疗法。
TCGT
致病机理主要是少量位于滑膜衬里的细胞由于
CSF-1
的染色体移位,造成其持续过量表达,从而吸引、招募过多的巨噬细胞造成的组织增生。早前,这类疾病还划归于自身免疫疾病,叫色素沉着绒毛结节性滑膜炎(
PVNS
,
pigmented villonodular synovitis
),也是有道理的。临床上,这类细胞瘤是验证
CSF-1/CSF-1R
靶向药物有效性的理想对象
[7]
。
最早
Imatinib
就对这个疾病进行了尝试。但由于
imatinib
的
CSF-1R
的活性较弱,总体应答率较低,只有
19%
。
Roche
的
CSF-1R
的抗体
emactuzumab
具有极高的活性。临床前的试验表明其能够有效地抑制
M2
类型的巨噬细胞,促进
T
细胞活性的增加
[8]
。在
TCGT
的临床试验中也表现出积极的应答率
86%(24/28)
。其中两例患者达到完全缓解
[9]
。进一步证明了
CSF-1/CSF-1R
信号通路的可靶向性。
Emactuzumab
的副作用主要包括面部水肿
(
眶周水肿
)、
乏力和瘙痒等。
小分子
CSF-1R
的激酶抑制剂在
TCGT
患者人群同样表现出优异的临床数据,
PLX-3397
的
ORR
达到
52%
(
12/23) [10]
。与
PLX-3397
相关的毒性主要包括:疲劳、头发颜色变化(
74%)、
恶心、味觉障碍、眶周水肿等。还不是非常确定哪些毒性是与靶向
CSF-1R
直接相关的。
尽管
PLX-3397
的选择性不错,报道的活性很高,它的
PK
也相当好,但它的临床试验使用剂量达到
1000 mg/
每天。有些怀疑它的活性可能没有其报道的高。与
CSF-1R
抗体的更高应答率、更小毒性相比,
PLX-3397
的临床患者有
61%
还需要通过减少剂量来降低毒性。
除了上面提到的
TCGT
,
CSF-1R
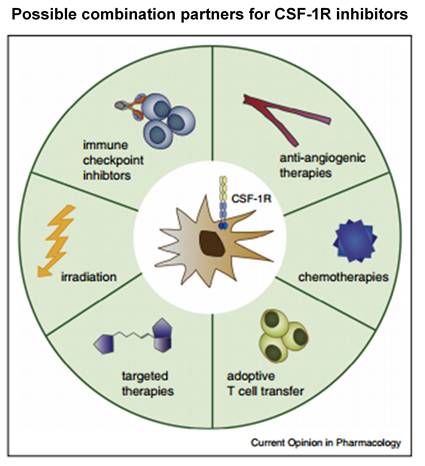
单用在其它诸多实体瘤的临床试验也在开展。目前得到的初步数据不是很积极,单用效果有限。
CSF-1R
的靶向潜力更多的应该是联合用药,与
IDO
抑制剂的情况类似,能不能达到
IDO
的联用效果还有待观察。
CD47
靶向药物
CD47–SIRPα
信号通路在调控巨噬细胞的吞噬过程中起重要作用。
SIRPα
和
CD47
均属于免疫球蛋白超家族的成员,分别在巨噬细胞和候选目标细胞中表达。在结合
CD47
后,
SIRPα
作为对接蛋白,结合
SHP1
和
SHP2
磷酸酶,从而抑制细胞内信号,并由此负调控吞噬作用。因此,
CD47
的生理作用表现为发布“不要吃我”(
Don’t eat me
)的信号
[11]
。
在正常生理情况下,
CD47
蛋白存在于很多健康细胞的表面,通过和巨噬细胞表面的
SIRPα(Signal regulatory protein-α)
结合来告诉巨噬细胞不要去“吞吃”它们,从而保护健康细胞不被清除。当细胞老化或病变时,细胞表面就会逐渐丧失
CD47
,巨噬细胞从而能够识别并处理掉衰老或病变细胞















