药物开发主要流程为:靶点确定、discovery、临床前药学研究(IND)、临床实验(临床I、II、III期)、NDA/BLA、上市,见下流程图。
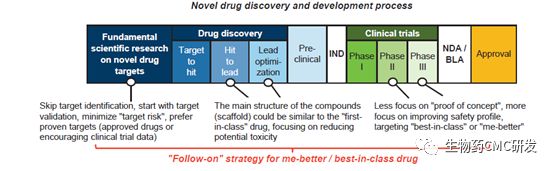
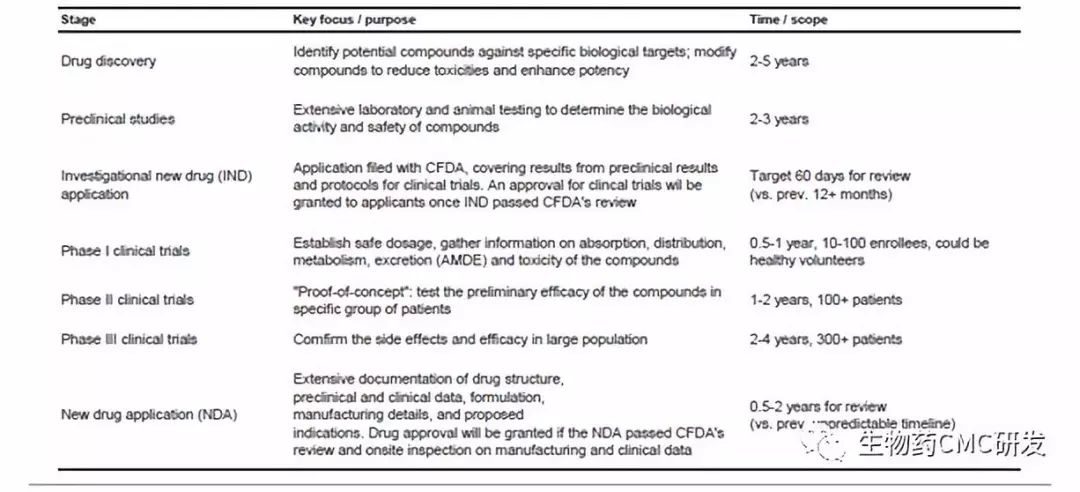
但实际上,每个阶段都是需要大量的工作与时间积累,才能走向最终上市,下表是将药物开发每个阶段关键点与时间表进行了汇总。其中discovery时间可能花的时间2-5年,笔者认为此部分工作花的时间与工作量,是非常之关键,因为它决定了后续模块的成败与速度,所以很多做药物开发的工作者,宁愿在discovery阶段将工作做得扎实详细。
 CMC(Chemical Manufacturing and Control),名词是沿用化学制药领域专有名词,也适用于生物制药,主要是生产工艺、杂质研究、质量研究,稳定性研究等药学研究资料,是药品申报资料中非常重要的部分,它是discovery与临床之间非常重要的环节,也是药品上市重要组成部分。
CMC(Chemical Manufacturing and Control),名词是沿用化学制药领域专有名词,也适用于生物制药,主要是生产工艺、杂质研究、质量研究,稳定性研究等药学研究资料,是药品申报资料中非常重要的部分,它是discovery与临床之间非常重要的环节,也是药品上市重要组成部分。
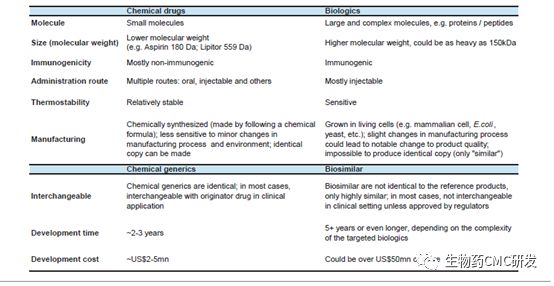
下表是化学制药与生物制药CMC领域对比,相对于化学制药CMC开发难度,生物制药更加难,因为生物药主要是由活的细胞或生物表达蛋白类大分子,蛋白的空间结构、翻译后修饰、稳定性等比化药复杂,工艺更加难以控制,所以在生物制药领域CMC需要结合生物技术的发展,不断提升CMC水平。
细胞株是单克隆抗体药物CMC非常重要的一个模块,细胞株的好坏,直接决定工艺开发的难度与药物质量好否,甚至决定后续放大生产的成败与速度。下面简单谈谈细胞株开发的几个关键点:
1)宿主细胞和Select Marker体系选择。CHO宿主细胞种类主要有:DG44、CHO K1、CHO-S、CHOK1SV(lonza公司2002年)和CHOK1SV GS-KO(Lonza公司2012年)、CHOZN CHO K1(Merk公司(原SAFC)2006年)、Horizon Discovery CHO-K1HD-BioP3(Horizon公司)等。其中Lonaza、Merk、Horizon公司的GS缺陷型宿主细胞,在克隆筛选阶段会缩短一定时间,但收费都较为昂贵;Lifetechnologies公司的CHO-S宿主细胞,在生长最高密度具有较大优势,Fed-batch培养基最高密度达到30×10
6
cells/ml以上,同时细胞培增时间在17-20小时范围,对于细胞工艺开发和放大,CHO-S宿主细胞是不错的选择。由于GS体系表达量较DHFR体系高,以及在细胞培养工艺以及放大过程中无需添加Glutamine或GlutaMax,能够避免谷氨酰胺分解造成培养体系中氨水平高的问题,降低工艺控制难度,可有效提高细胞密度和延长细胞生存时间,同时也节省Glutamine或GlutaMax试剂费用。
2)表达载体构建。CHO细胞表达载体,主要在启动子、密码子会进行优化工作,如果是设计单个载体系统,即将轻链、重链插入一个载体中,在启动子方面可能会有差异,一般重链的启动子比轻链的启动子要强。当然商业化的表达载体,目前使用较多的是Life technologies公司的Freedom pCHO1.0载体,它是单个载体系统,基本与CHO-S宿主细胞配套,一般细胞株可以做到3.0 g/L。
3)单克隆筛选技术。目前随着科技的发展,有传统的有限稀释法、流式细胞仪法、Clone Pix system筛选法、Single Cell Printer(Cytena)、Beacon单细胞光导系统筛选法。当然还有单克隆影像学拍照仪器,如:MolecularDevices公司的CSI(Cell SelectImager)仪器、Solentim公司的Cell Metric或Cell Metric CLD等。仪器越来越高效、越来越智能化。尤其一些新技术,国内引进比较晚,例如Single Cell Printer(Cytena)、Beacon单细胞光导系统筛选法两个方法,国内企业还没有正式使用,最近有两三家刚刚购买。SingleCell Printer分选细胞较流式细胞仪对细胞的损伤要小很多,由于流式细胞仪的鞘液压力较大,以及电场的影响,导致细胞分选过程受损。Beacon单细胞光导系统是集抗体研发和细胞株构建一体的仪器,最大的优点可以快速检测单个细胞表达量以及细胞株的稳定性。
4)定点整合技术。目前工业上主要是外源基因随机整合到宿主细胞基因组中,通常需要多轮克隆筛选才能产生可接受的高表达克隆,但每当构建新的表达体系时仍然要重新筛选单克隆过程。同源重组或CRISPR/Cas9介导的同源重组技术,对已知强转录活性区实现同源重组,形成可定点插入目的基因的“Landing Pad”,大多数在强转录活性区。定点插入目的基因的细胞无需进行单克隆筛选,在有无选择压力条件下均可实现目的基因的高效稳定表达。但此技术还未大规模推广,主要原因应该技术还未成熟。
1)灌注培养工艺。流加工艺(Fed-batch)和灌流工艺(Perfusion)在达到相同的生产量,培养的体积可能相差10倍左右,所以在很多制药企业,在受场地限制和生产规模限制,而且随着Perfusion工艺技术的提高,很多产品会更加选择Perfusion工艺进行生产。例如,原来产品规模需要2000L规模,如果选择Perfusion工艺,可能仅仅需要200L规模。然而,国内使用Perfusion工艺生产单抗药物的企业局指可数,药明生物、嘉和生物、复宏汉霖等企业具有Perfusion工艺平台,其他大部分企业依然使用Fed-batch工艺。但Perfusion是单抗产业化发展的一个趋势,同时国内企业具有自主开发的培养基,成本也大大降低;国产品牌培养基发展迅速,例如
建顺、













